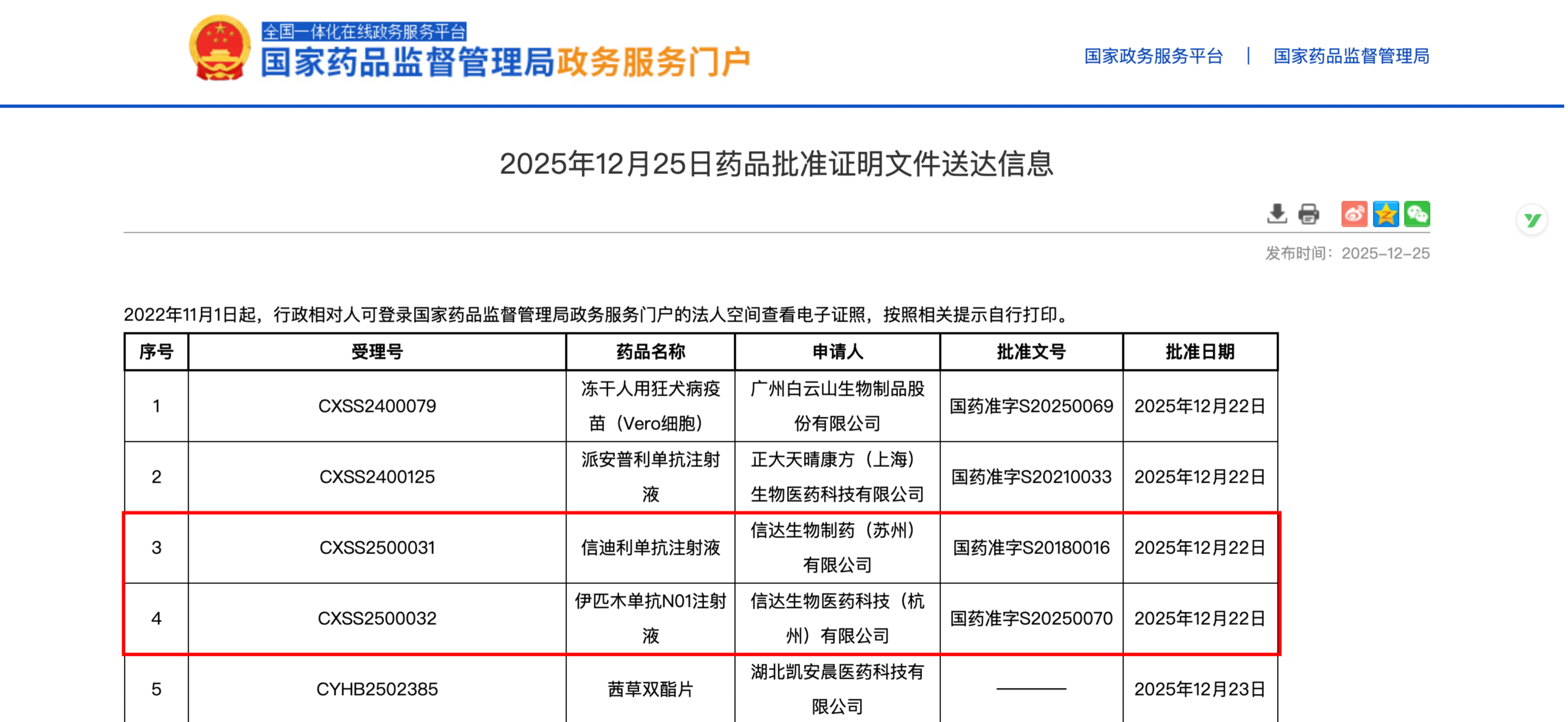
12月25日,信达生物制药集团自主研发的抗CTLA-4单抗伊匹木单抗N01注射液(商品名:达伯欣)正式获国家药监局批准,联合PD-1抑制剂信迪利单抗注射液(达伯舒),用于可手术切除的IIB-Ⅲ期微卫星高度不稳定型(MSI-H)或错配修复缺陷型(dMMR)结肠癌患者的新辅助治疗。
这是全球首个在该适应症上获批的“双免疫”新辅助治疗方案,也是中国首个国产抗CTLA-4抑制剂上市,标志着我国在结肠癌术前治疗领域实现重要突破。
在我国,结肠癌是常见的消化道恶性肿瘤,其中约15%的可手术患者属于MSI-H/dMMR类型。这类肿瘤对传统化疗不敏感,长期以来缺乏有效的新辅助治疗方案,患者大多只能接受“手术+化疗”模式,术后复发风险较高,且化疗副作用显著。
信达生物的双免疫组合疗法改变了这一局面。该方案通过同时抑制CTLA-4和PD-1两个免疫检查点,激活患者自身免疫系统攻击肿瘤细胞,在手术前即实现对肿瘤的高效清除。
该适应症的获批基于在中国开展的Ⅲ期注册研究NeoShot-Ⅲ的期中分析数据。研究显示,在首批50例可手术切除的MSI-H/dMMR结肠癌患者中,82%的患者在接受双免新辅助治疗后达到病理完全缓解(pCR),即在手术切除标本中未检测到存活肿瘤细胞。此外,手术完全切除率达100%,且多数患者术后无需进行辅助化疗。
该研究的主要研究者、中国工程院院士、中山大学肿瘤防治中心院长徐瑞华教授表示,NeoShot-Ⅲ研究是首个在可手术切除的MSI-H/dMMR结肠癌中显示双免新辅助治疗显著疗效的注册研究。该适应症获批上市将改变临床实践,填补结肠癌新辅助治疗领域的空白,让更多结肠癌患者获益。
此前,该联合疗法的Ib期研究结果已于2025年10月以封面文章形式发表于国际顶级期刊《Cancer Cell》,早期数据已显示出显著优于单药治疗的肿瘤缓解率。
作为这一方案的核心药物之一,达伯欣是中国首个由本土企业自主开发的抗CTLA-4抑制剂,与其联合使用的达伯舒,目前已在中国获批多个适应症并广泛用于肺癌、肝癌、食管癌等高发癌种,本次与达伯欣的双免组合成为达伯舒在中国获批的第9项适应症。
随着该款新药获批,信达生物2025年已成功上市7款创新药。截至目前,公司已累计获批18款创新药物,在肿瘤、代谢、自身免疫和眼科四大疾病领域均有重磅产品布局。信达生物表示,随着多款新品陆续上市与放量,公司“2027年产品收入突破200亿元”的目标正稳步推进。
南方+记者 严慧芳
订阅后可查看全文(剩余80%)